試験の概要、安全性及び有効性の結果は1、2回目の両中間解析(中間解析1:2022年3月2日、中間解析2:2022年12月1日をデータカットオフ日とした解析)に基づいて記載し、薬力学及び免疫原性の結果は1回目の中間解析(2022年1月12日をデータカットオフ日とした解析)に基づいて記載しています。
ARGX-113-2002/ADAPT-SC+試験(国際共同第Ⅲ相継続投与試験)
「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
試験概要
目的
gMG患者に対する、ヒフデュラ®の長期安全性と忍容性を評価する
試験デザイン
第Ⅲ相、ARGX-113-1705·ARGX-113-2001の継続投与、長期、単群、非盲検、多施設共同(欧州、米国、ロシア、日本の47施設)
対象
ARGX-113-2001又はARGX-113-1705※1に参加したgMG患者184例(日本人16例)
中間解析1の時点での投与患者:164例(日本人14例)
- ARGX-113-2001でヒフデュラ®の投与を受けた患者51例(日本人4例)
- ARGX-113-2001でウィフガート®の投与を受けた患者48例(日本人3例)
- ARGX-113-1705でウィフガート®の投与を受けた患者65例(日本人7例)
中間解析2の時点での投与患者:179例(日本人16例)
- ARGX-113-2001でヒフデュラ®の投与を受けた患者52例
- ARGX-113-2001でウィフガート®の投与を受けた患者50例
- ARGX-113-1705でウィフガート®の投与を受けた患者77例
※1:ARGX-113-1705は、第Ⅲ相ARGX-113-1704からの3年間の継続投与試験であり、パートA(1年)及びパートB(最長2年)の連続した2つのパートで実施されている。
主な選択基準
ARGX-113-2001又はARGX-113-1705に参加し、以下の基準を満たす患者
- ARGX-113-2001に参加した患者:
- 試験を完了し、試験終了来院を実施した。
又は - 「妊娠又は生命を脅かす重篤な有害事象」以外の理由で治験薬投与を中止した。
- 試験を完了し、試験終了来院を実施した。
- ARGX-113-1705に参加した患者:
- パートAの最終時点の規定の評価を実施した。
又は - パートBを開始し、ARGX-113-1705の参加期間が1年以上で、かつ、最後のウィフガート®の投与が本試験への組み入れの30日以上前であり、ARGX-113-1705の早期中止来院の評価を完了した。
- パートAで、3回の連続する規定来院で「効果不十分」※2が認められなかった。
なお、レスキュー療法の有無は問わない(ただし、生命を脅かす状況に対応してレスキュー療法が実施された場合を除く)。 - 併用MG療法を継続中である(併用MG療法を受けていない場合は不適格)。
- パートAの最終時点の規定の評価を実施した。
※2:「 効果不十分」とは、対応する治験薬投与期のベースラインと比べてMG-ADL総スコアの2点以上の減少が評価時点の50%以上の時点で認められないことと定義した。
投与方法
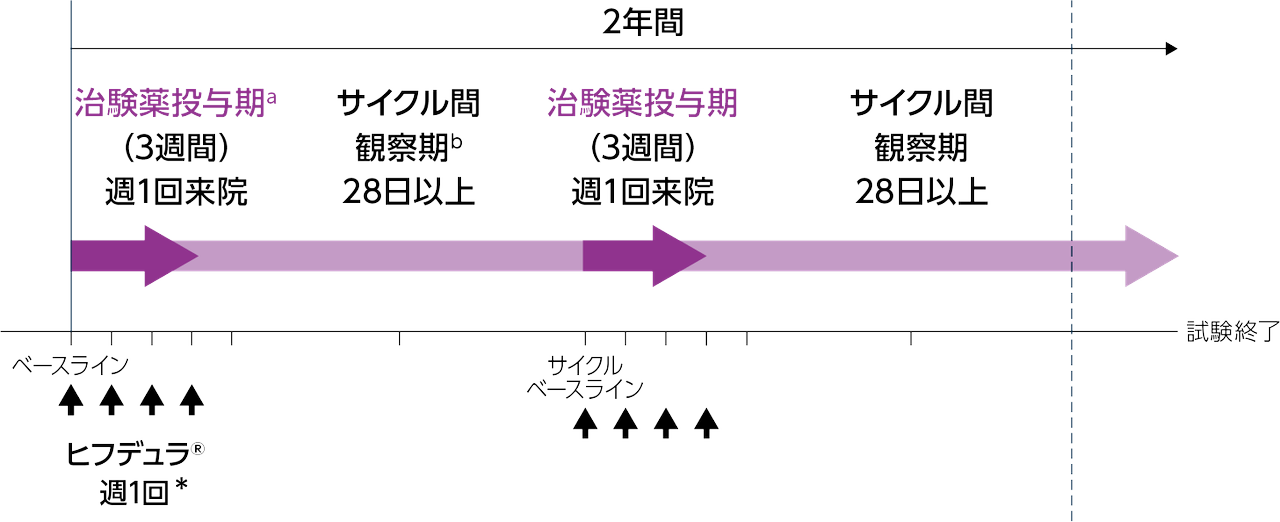
ヒフデュラ®[エフガルチギモド アルファ(遺伝子組換え)として1,008mg及びボルヒアルロニダーゼ アルファ(遺伝子組換え)として11,200単位]を週1回計4回皮下投与する*。これを1サイクルとし、臨床評価に基づき必要に応じてこれを繰り返す。必要な場合、28日以上の間隔をあけて投与期を繰り返す。
*ヒフデュラ®はバイアル製剤を使用した。
6. 用法及び用量(抜粋) 〈全身型重症筋無力症〉
【ヒフデュラ®配合皮下注】通常、成人には本剤1回5.6mL(エフガルチギモド アルファ(遺伝子組換え)として1,008mg及びボルヒアルロニダーゼ アルファ(遺伝子組換え)として11,200単位)を1週間間隔で4回皮下投与する。これを1サイクルとして、投与を繰り返す。
7. 用法及び用量に関連する注意(抜粋) 〈全身型重症筋無力症〉
7.1 次サイクル投与の必要性は、臨床症状等に基づき、判断すること。[17.1.1、17.1.2参照]
a 患者は、ヒフデュラ®を1回の治験薬投与期で週1回計4回注射された。①エフガルチギモドの最終投与から28日以上経過し、②治験責任医師により再治療が必要と判断された場合に治験薬投与が開始された。
b サイクル間観察期の初回来院はヒフデュラ®の最終投与から7日後とした。その後は21日毎に来院した。サイクル間観察期は臨床反応に基づき、患者間で異なった。
評価項目
【主要評価項目】
有害事象の発現割合と重症度
重篤な有害事象及び特に注目すべき有害事象の発現割合
臨床検査値、身体所見、バイタルサイン及び心電図の変化
【副次評価項目】
MG-ADL総スコアのベースライン及びサイクルベースラインからの変化量のサイクルごとの推移
総IgG濃度のベースライン及びサイクルベースラインからの減少率のサイクルごとの推移
抗AChR抗体陽性患者を対象とした、抗AChR抗体濃度のベースライン及びサイクルベースラインからの減少率のサイクルごとの推移
薬物動態、免疫原性、QOLへの影響、自己投与の実施可能性 など
【探索的評価項目】
ヒフデュラ®治療に対する選好性及び満足度評価
解析方法
主要評価項目及び副次評価項目は、ARGX-113-2001及びARGX-113-1705の投与群別に記述統計量で要約した。
- ARGX-113-2001のヒフデュラ®群から移行した患者(SC 2001群)
- ARGX-113-2001のウィフガート®群から移行した患者(IV 2001群)
- ARGX-113-1705から移行した患者(IV 1705群)
- これらの先行試験でウィフガート®の投与を受けた患者全体(Total IV群)
試験結果はARGX-113-2001及びARGX-113-1705から移行した患者の全体及び抗AChR抗体陽性/陰性別に要約した。
特に指定のない限り、全ての有害事象及び臨床検査値異常は治験薬による治療下で発現したものを表示した。
また、有害事象はサイクル別での要約も行った。
主要評価項目
安全性評価
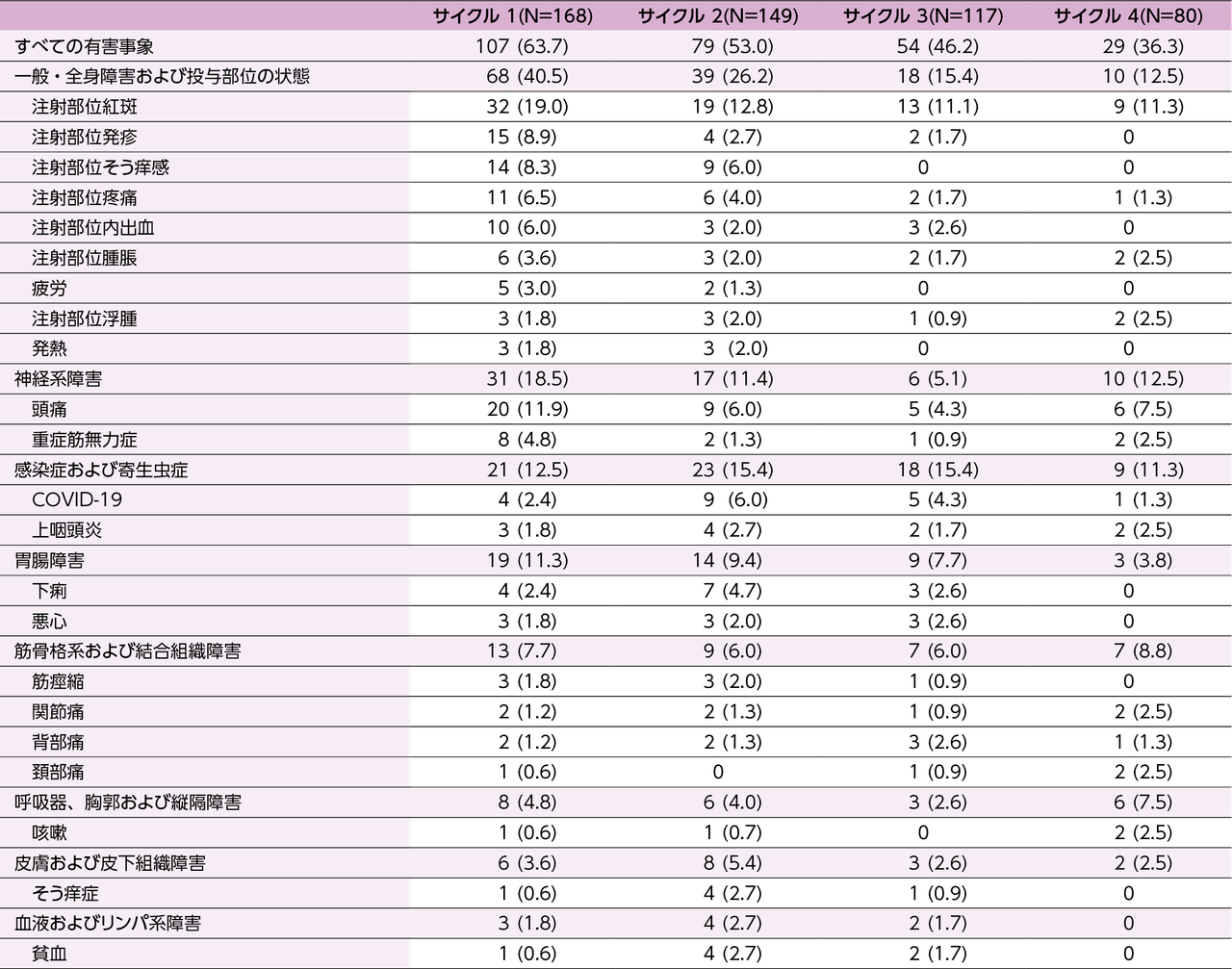
有害事象(2022年12月1日データカットオフ時点)
- 有害事象はヒフデュラ®全体群179例中152例(84.9%)に認められました。治験担当医師により因果関係が否定されなかった有害事象は96例(53.6%)に発現しました。また、局所の注射部位反応は45.8%でした。
- 主な有害事象(全体群の10%以上に発現)は、注射部位紅斑が52例(29.1%)、COVID-19が40例(22.3%)、頭痛が36例(20.1%)、上咽頭炎が28例(15.6%)、下痢が24例(13.4%)、注射部位疼痛が21例(11.7%)、注射部位そう痒感が19例(10.6%)及び注射部位内出血が18例(10.1%)でした。
- 重篤な有害事象は33例(18.4%)に認められ、重症筋無力症が7例、COVID-19が3例、重症筋無力症クリーゼが2例、重症筋無力症·重症筋無力症が2例、脊椎骨折、呼吸困難、蜂巣炎、重症筋無力症·重症筋無力症·重症筋無力症、感染性下痢·ロタウイルス感染、腱損傷、尺骨神経損傷、肋骨骨折·筋力低下、肛門膿瘍、卵巣腺腫·重症筋無力症、うっ血性心不全、重症筋無力症クリーゼ·重症筋無力症クリーゼ、急性呼吸不全·COVID-19 肺炎、ヘルニア修復、シャント閉塞·硝子体出血、肺炎·COVID-19·呼吸不全·昏睡·腸管穿孔·敗血症、変形性関節症、末端回腸炎、処置後合併症が各1例でした。
- 投与中止に至った有害事象は4例(心停止、遠隔転移を伴う腎癌、COVID-19及び呼吸不全、重症筋無力症クリーゼが各1例)に認められました。
- 本試験では4例(心停止、遠隔転移を伴う腎癌、肺腫瘤、COVID-19及び呼吸不全が各1例)の死亡が報告されました。いずれの事象も治験担当医師によりヒフデュラ®との因果関係は否定されました。
いずれかのサイクルで2%以上の患者に発現した有害事象(サイクル別)
(ARGX-113-2001及びARGX-113-2002の統合解析)
(ARGX-113-2001及びARGX-113-2002の統合解析)
発現例数(%)
MedDRA version 24.1
対象・方法:対象はARGX-113-2001及びARGX-113-2002(継続中、2022年3月2日の安全性データカットオフ日まで)でヒフデュラ®の投与を受けた168例。
解析は試験を問わずサイクル別に実施し、サイクル1でのデータはARGX-113-2001及びARGX-113-2002から入手し、サイクル2以降のデータはARGX-113-2002から入手した。
臨床検査値、バイタルサイン及び心電図の変化(2022年3月2日データカットオフ時点)
臨床検査値
血液生化学検査、血液学的検査及び尿検査では、各パラメータのベースラインからの変動は多くは見られませんでした。
グレード3の臨床検査値異常の多くは、各1例(0.6%)に発現しました。
臨床検査値異常のリンパ球数減少は、グレード3が12例(7.5%)、グレード4が1例(0.6%)に認められました。
バイタルサイン
バイタルサインの測定値について、ベースラインから臨床的に意味のある変化は認められませんでした。
心電図
心電図パラメータについて、ベースラインから臨床的に意味のある変化は認められませんでした。
有効性評価(2022年3月2日データカットオフ時点)
副次評価項目
MG-ADL総スコア変化量のサイクルごとの推移
全体群におけるMG-ADL総スコアのベースラインからの変化量(平均値±標準誤差)のサイクルごとの推移は下図のとおりでした。
ベースラインのMG-ADL総スコアの平均値(標準誤差)は7.9点(0.27)で、4週目のMG-ADL総スコアのベースラインからの変化量の平均値(標準誤差)および4週目のMG-ADL総スコアのサイクルベースラインからの変化量の平均値(標準誤差)は下表のとおりでした。
MG-ADL総スコア変化量のサイクルごとの推移
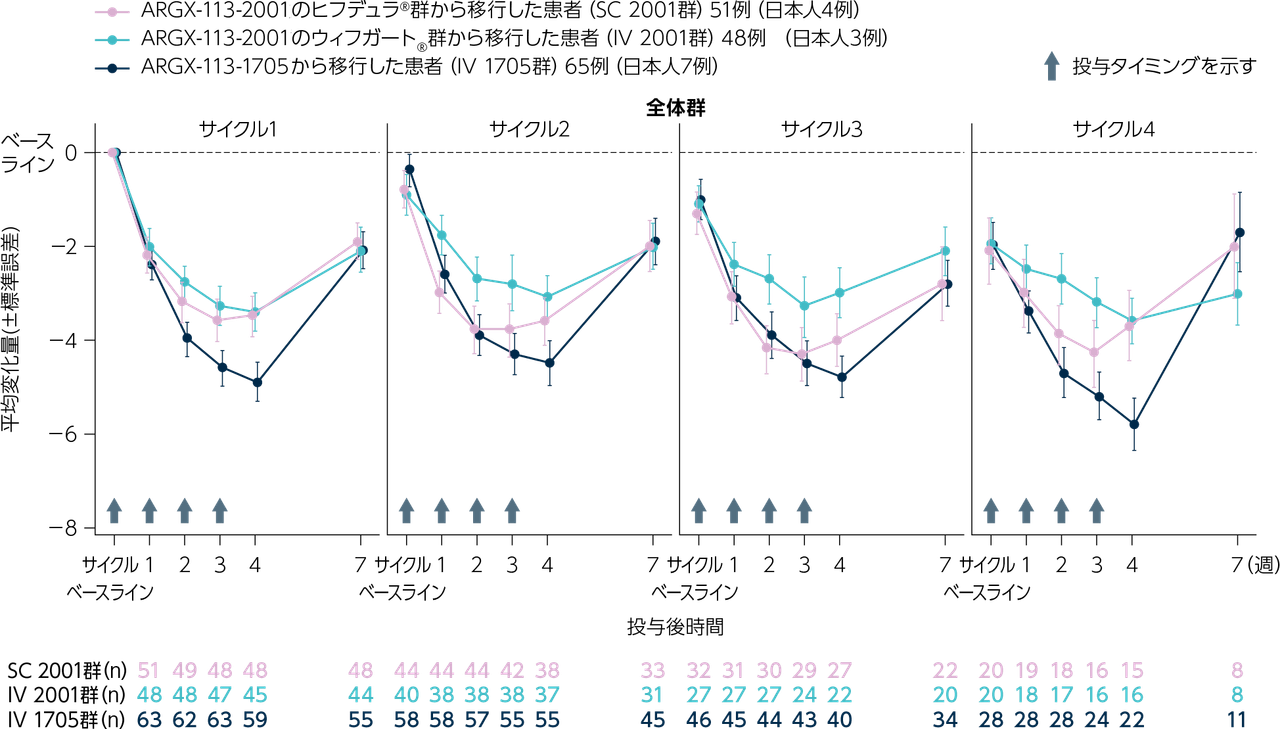
※ 試験のベースラインは、サイクル1のヒフデュラ®初回投与前の最後の入手可能なスコアに相当する。サイクルベースラインは、そのサイクルのヒフデュラ®初回投与前の最後の入手可能なスコアに相当する。

MG-ADL総スコアのベースラインからの変化量の平均値(標準誤差)の推移:
抗AChR抗体陽性/陰性別
抗AChR抗体陽性/陰性別
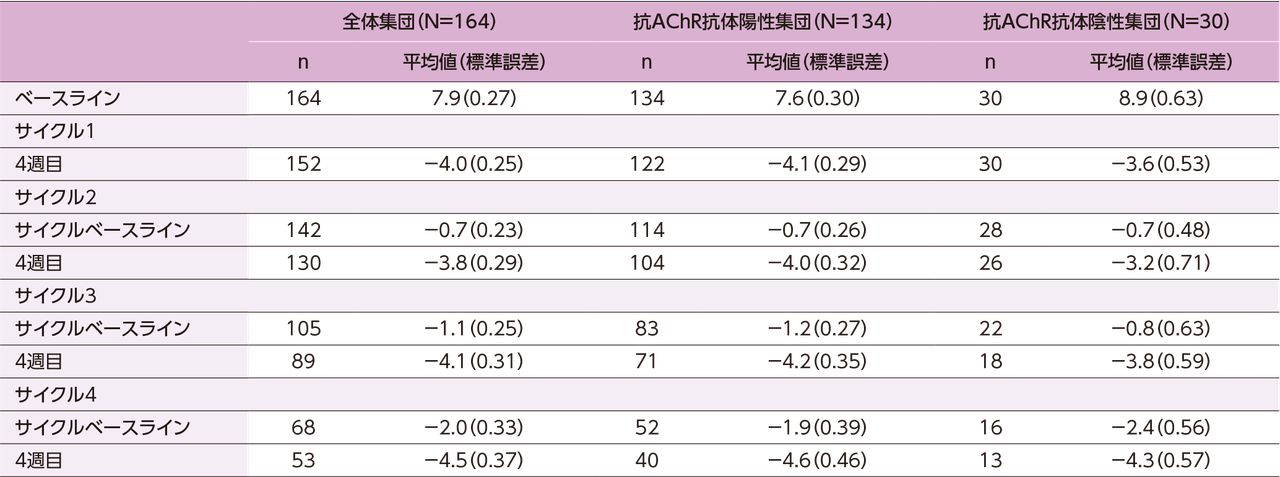
※ ベースラインは、サイクル1における最初のヒフデュラ®投与直前の値である。サイクルベースラインは、各サイクルにおける最初のヒフデュラ®投与直前の値である。サイクル1~4におけるベースラインでのMG-ADL総スコア、サイクルベースラインでのベースラインからの変化量、4週目でのベースラインからの変化量を示す。
MG-QoL15r総スコアのベースライン及びサイクルベースラインからの変化量のサイクルごとの推移
MG-QoL15r総スコアは、先行試験でのエフガルチギモド投与期間や投与経路にかかわらず、ベースライン及びサイクルベースラインから減少を示しました。
EQ-5D-5L VASスコアのベースライン及びサイクルベースラインからの変化量のサイクルごとの推移
EQ-5D-5L VASスコアは、先行試験でのエフガルチギモド投与期間や投与経路にかかわらず、ベースライン及びサイクルベースラインから増加を示しました。EQ-5D-5L VASスコアの最大値は、各サイクルの4週目に認められました。
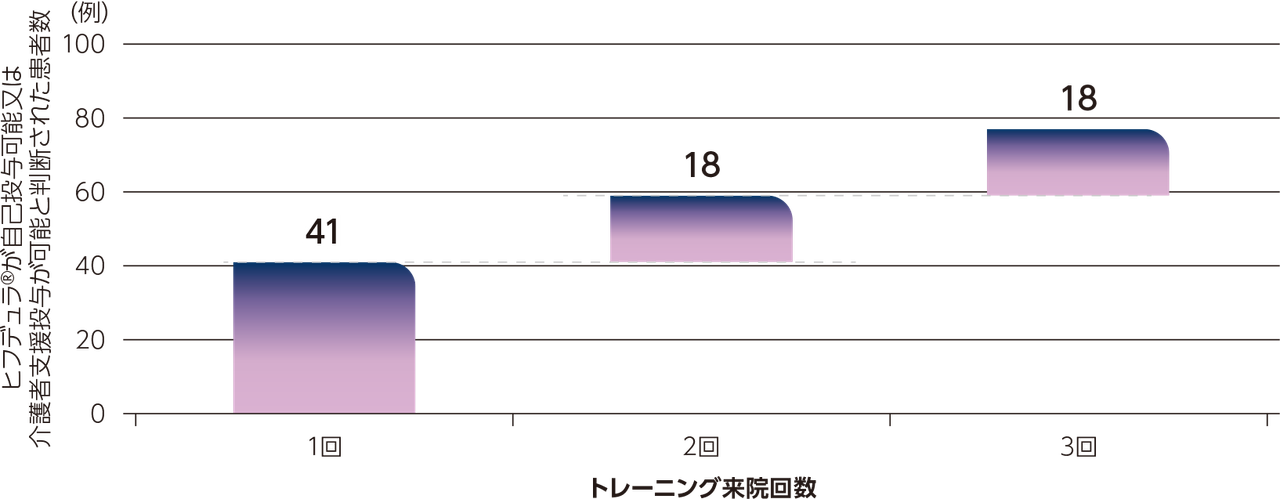
患者又は介護者がヒフデュラ®の投与を開始するために必要としたトレーニング来院の回数
全体集団164例の患者又はその介護者が、医療従事者によるヒフデュラ®投与を開始するためのトレーニングを受け、そのうち145例(88.4%)がヒフデュラ®の自己投与又は介護者支援投与が可能と判断されました。
先行試験でヒフデュラ®投与ではなかった患者(Total IV群)113例では、ヒフデュラ®が投与可能と判断されるまでのトレーニング来院回数は、1回が41例、2回が18例、3回が18例でした。
※治験時は薬液採取には注射針、投与時には翼状針を使用したため、薬事承認後と使用機器が異なる。ヒフデュラ®はバイアル製剤を使用した。
自己投与及び介護者支援投与の実施状況(日本人/外国人別)
ヒフデュラ®の総投与回数における投与方法の内訳
日本人患者集団:治験実施施設のスタッフによる投与44.6%、治験実施施設での自己投与36.7%、在宅での自己投与18.7%
外国人患者集団:治験実施施設のスタッフによる投与42.6%、在宅での自己投与31.6%、治験実施施設での自己投与23.7%、治験実施施設での介護者支援投与1.0%、在宅での介護者支援投与0.9%、在宅での訪問看護師による投与0.1%、在宅での治験実施施設のスタッフによる投与0.1%
日本人患者14例中9例(64.3%)が、ヒフデュラ®のトレーニング後に自己投与可能と判断され、実際に在宅で自己投与を行った患者は5例でした。

※治験時は薬液採取には注射針、投与時には翼状針を使用したため、薬事承認後と使用機器が異なる。ヒフデュラ®はバイアル製剤を使用した。
探索的評価項目
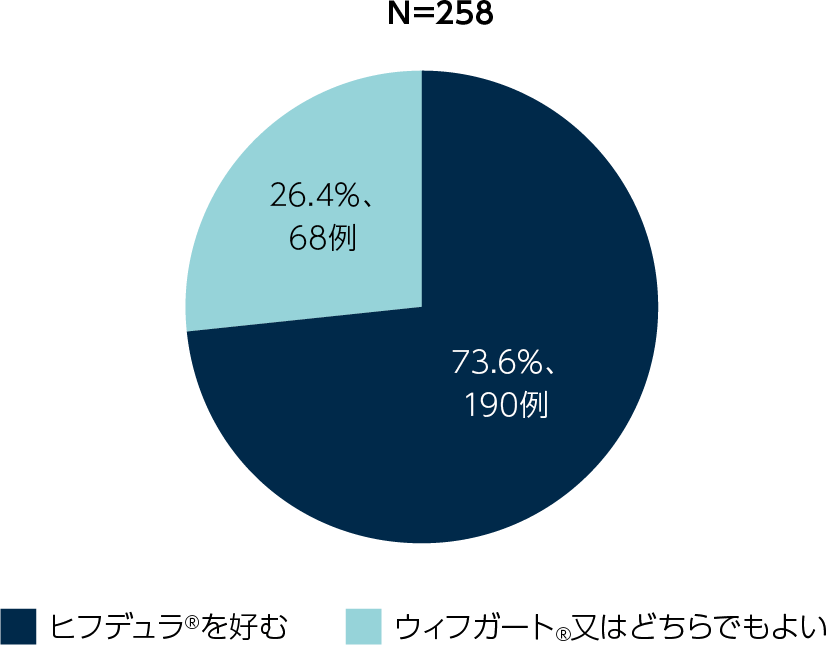
ウィフガート®とヒフデュラ®の両方の投与を受けたことがある患者の選好性
ウィフガート®とヒフデュラ®の両方の投与を受けたことがある患者(ARGX-113-1705又はARGX-113-2001でウィフガート®の投与を受けており、ARGX-113-2002でヒフデュラ®の投与を受けた患者)に対し、MAPQ(Mode of Administration Preference Question:投与方法の好みに関する質問)を用いて、ウィフガート® (点滴静注)又はヒフデュラ® (皮下投与)のどちらを好むかを評価しました。
ウィフガート®とヒフデュラ®の両方の投与を受けたことがある患者におけるヒフデュラ®の各サイクル投与終了後の結果として、サイクル1で104例中74例(71.2%)、サイクル2で92例中67例(72.8%)、サイクル3で62例中49例(79.0%)の患者がウィフガート®よりもヒフデュラ®の投与方法を好みました。
全体では、患者の73.6%がウィフガート®投与よりもヒフデュラ®投与を好みました(名目上のp値<0.0001、一般化推定方程式)。
ウィフガート®よりもヒフデュラ®を好むオッズ比は21.2(95%信頼区間:9.57,47.14)でした(名目上のp値<0.0001)。
先行試験でウィフガート®を投与された患者のMAPQ選好性
※治験時は薬液採取には注射針、投与時には翼状針を使用したため、薬事承認後と使用機器が異なる。ヒフデュラ®はバイアル製剤を使用した。
8. 重要な基本的注意(抜粋)
【ヒフデュラ®配合皮下注】
8.2 本剤の自己投与に際しては、以下の点に注意すること。
・自己投与の適用については、医師がその妥当性を慎重に検討し、十分な教育訓練を実施した後、本剤投与による危険性と対処法について患者が理解し、自ら確実に投与できることを確認した上で、医師の管理指導の下で実施すること。
・使用済みの注射針及び注射器を再使用しないように患者に注意を促し、すべての器具の安全な廃棄方法に関する指導を行うこと。
【ヒフデュラ®配合皮下注シリンジ】
8.2 本剤の自己投与に際しては、以下の点に注意すること。
・本剤の投与開始にあたっては、医療施設において、必ず医師によるか、医師の直接の監督のもとで投与を行うこと。
・自己投与の適用については、医師がその妥当性を慎重に検討し、十分な教育訓練を実施した後、本剤投与による危険性と対処法について患者が理解し、患者自ら確実に投与できることを確認した上で、医師の管理指導の下で実施すること。また、適用後、本剤による副作用が疑われる場合や自己投与の継続が困難な状況となる可能性がある場合には、直ちに自己投与を中止させ、医師の管理下で慎重に観察するなど適切な処置を行うこと。
・使用済みの注射針及び注射器を再使用しないように患者に注意を促し、すべての器具の安全な廃棄方法に関する指導を行うこと。
各治療サイクルの期間(中央値)(2022年12月1日データカットオフ時点)
ヒフデュラ®各治療サイクルの初回投与時から次のサイクル投与開始時までの期間の中央値は、サイクル1が57.0日、サイクル2が57.0日、サイクル3が52.5日、サイクル4が51.0日、サイクル5が51.0日、サイクル6が51.0日、サイクル7が51.0日、サイクル8が50.0日、サイクル9が50.0日であり、約7.1~8.1週間の範囲でした。
社内資料:日本人集団の結果(2024年1月承認、CTD2.7.3.3.3.2)(EFG90057)
社内資料:第Ⅲ相試験(ARGX-113-2002)(2024年1月承認、CTD2.7.6.4)(EFG90051)
社内資料:効果の持続、耐薬性(2024年1月承認、CTD2.7.3.5)(EFG90078)
社内資料:2002試験(補足試験:2001試験及び1705試験の非盲検継続投与第3相試験)中間解析1(2024年1月承認、CTD2.7.3.2.3)(EFG90058)
おすすめコンテンツ
JP-VDJCIDP-25-00752(2025年12月作成)
