評価項目
【主要評価項目】
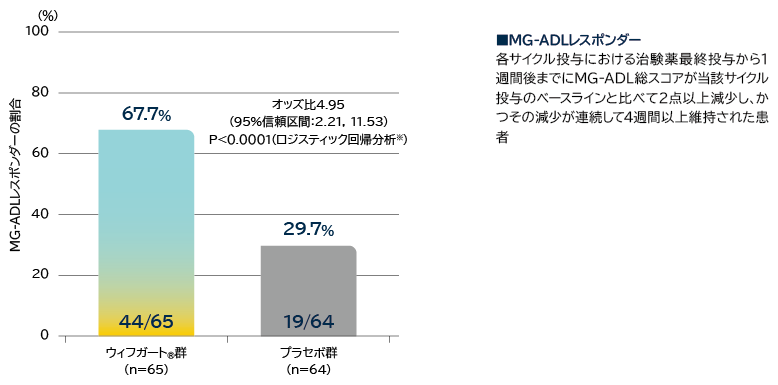
抗AChR抗体陽性患者の初回サイクルのMG-ADLレスポンダー※1の割合(検証項目)
【副次評価項目】
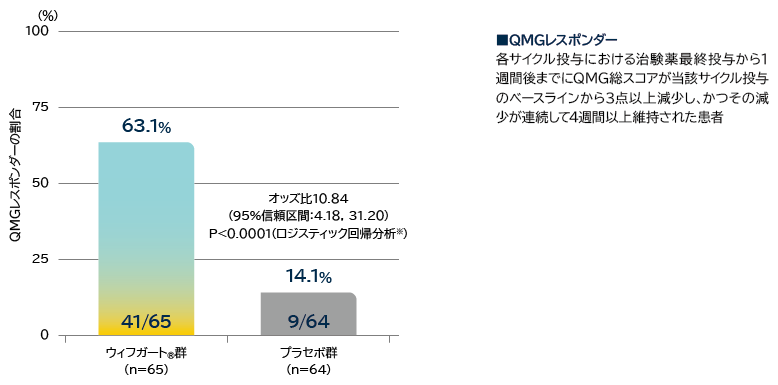
- 抗AChR抗体陽性患者の初回サイクルのQMGレスポンダー※2の割合
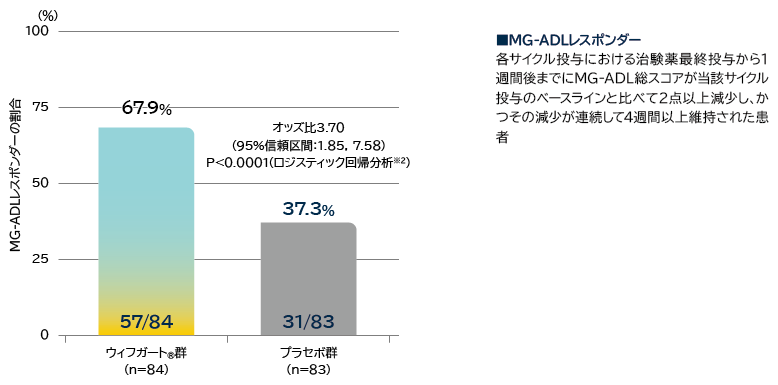
- 全体集団(抗AChR抗体陽性及び陰性患者)の初回サイクルのMG-ADLレスポンダーの割合
- 抗AChR抗体陽性患者の試験期間中(Day 126まで)にMG-ADL総スコアで臨床的に意味のある改善(CMI)※3が認められた期間の割合
- 抗AChR抗体陽性患者の初回サイクルの治験薬最終投与の1週間後から次のサイクルを開始する基準に合致するまでの期間
- 抗AChR抗体陽性患者の初回サイクルの早期MG-ADLレスポンダー※4の割合
【探索的及びその他の評価項目※5】
- 全体集団(抗AChR抗体陽性及び陰性患者)の初回サイクルのQMGレスポンダーの割合※6
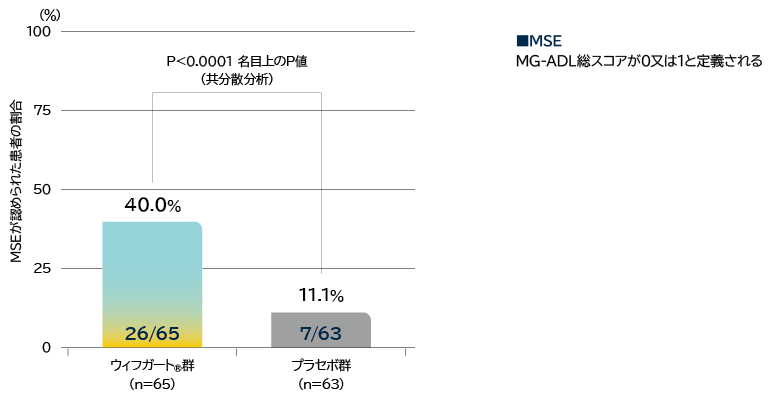
- 抗AChR抗体陽性患者の初回サイクルのいずれかの時点でMinimal Symptom Expression(MSE)※7が認められた患者の割合
- 抗AChR抗体陰性患者の初回サイクルのMG-ADLレスポンダーの割合
- 抗AChR抗体陰性患者の初回サイクルのQMGレスポンダーの割合
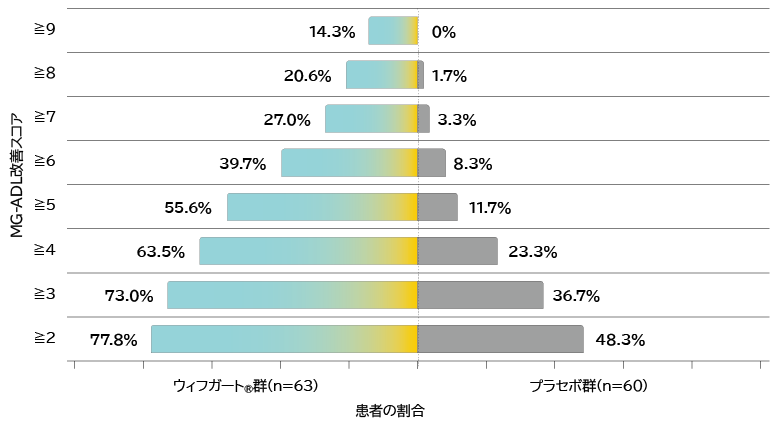
- 抗AChR抗体陽性患者の初回サイクル(Week 4)のMG-ADL改善スコア別の患者の割合
- 抗AChR抗体陽性患者の初回サイクル(Week 4)のQMG改善スコア別の患者の割合
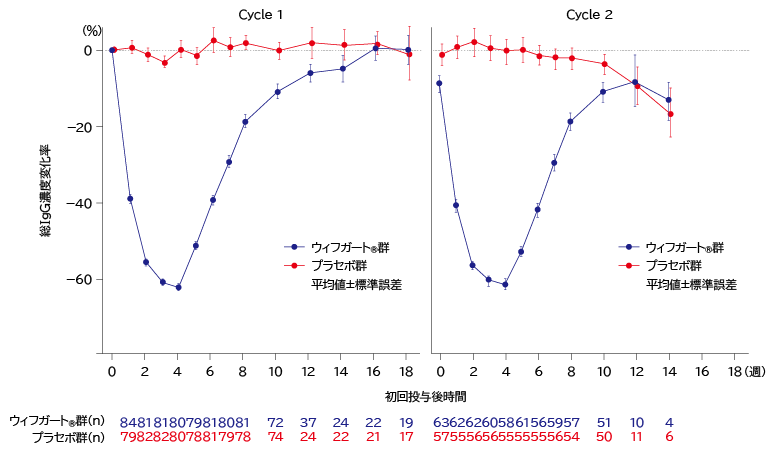
- 臨床効果の発現時期及び持続期間
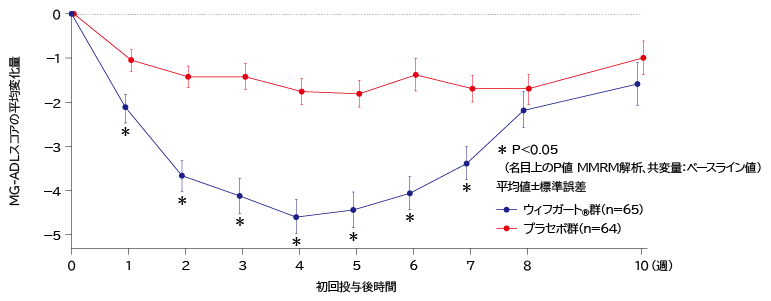
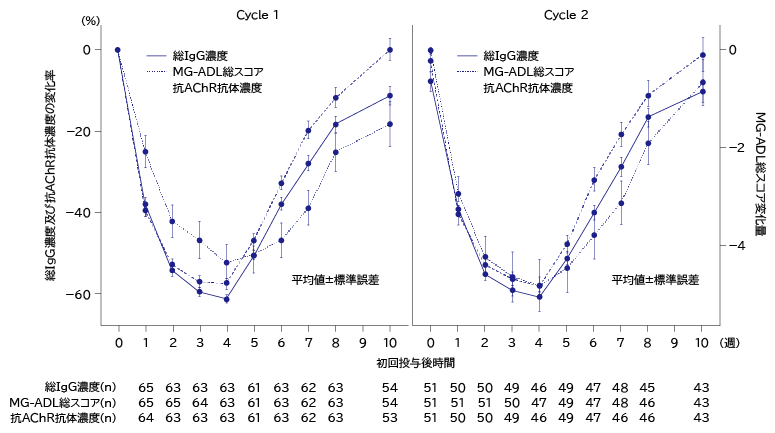
- 抗AChR抗体陽性患者の初回サイクルのMG-ADL総スコア推移
- 抗AChR抗体陽性患者の初回サイクルのQMG総スコア推移
- 抗AChR抗体陽性患者の初回サイクルの15-Item Quality of Life Scale for Myasthenia Gravis(revised version)(MG-QoL15r)総スコア推移
※1: 各サイクル投与における治験薬最終投与から1週間後までにMG-ADL総スコアが当該サイクル投与のベースラインと比べて2点以上減少し、かつその減少が連続して4週間以上維持された患者
※2: 各サイクル投与における治験薬最終投与から1週間後までにQMG総スコアが当該サイクル投与のベースラインから3点以上減少し、かつその減少が連続して4週間以上維持された患者
※3:MG-ADLのCMIは、MG-ADL総スコアの2点以上の減少として確立されている7,8)
※4: 各サイクルで治験薬初回投与日からWeek 2(治験薬投与開始2週間後)までにMG-ADL総スコアが当該サイクルベースラインから2点以上減少し、その減少が、連続して4週間以上維持された患者
※5: 解析前に規定していた評価項目
※6: 探索的評価項目
※7: MG-ADL総スコアが0又は1と定義される
【その他】
安全性、薬物動態、薬⼒学、免疫原性
探索的評価項目として、抗体陰性患者群におけるMG-ADLレスポンダーの割合、QMGレスポンダーの割合をそれぞれ紹介しているが、両評価項目のレスポンダー情報は当該患者集団における情報として、承認時に評価されたため、事後解析であるが紹介する。
解析方法
主要評価項⽬及び副次評価項⽬では多重性を調整し第⼀種の過誤を制御するため、ゲートキーピング法を⽤いた。主要評価項⽬を有意⽔準両側5%で検定し、副次評価項⽬の検定のゲートキーパーとした。主要評価項⽬及び副次評価項⽬は厳密な階層順序により段階的に検定した。「副次評価項⽬」1.〜5.の順に検定を⾏い、前段階の検定結果が有意⽔準両側5%で有意でない場合は、以降の評価項⽬の検定は実施しないこととした。
【主要評価項目】
抗AChR抗体陽性患者を対象として、⼈種(⽇本⼈/外国⼈)及びベースライン治療(⾮ステロイド系免疫抑制剤※あり/なし)で層別し、ベースラインのMG-ADL総スコアを共変量とした両側正確検定(ロジスティック回帰を⽤いた)により、有意⽔準両側5%で検定した。治療効果は、オッズ⽐をその95%信頼区間とともに表⽰した。
※:アザチオプリン†、メトトレキサート†、シクロスポリン、タクロリムス、ミコフェノール酸モフェチル†及びシクロホスファミド†
†:MGの治療に対し、本邦未承認である。
【副次評価項目】
MG-ADL及びQMG総スコアに関する反応パラメータの解析には、有効性の主要評価項⽬と同様のロジスティック回帰モデルを適⽤した。全体集団(抗AChR抗体陽性及び陰性患者)を対象とした解析では層別因⼦に抗AChR抗体発現状況(陽性/陰性)を追加した。
CMIを⽰した期間の割合は、治療(ランダム化時)及び各サイクルのベースライン時の総スコアを共変量とした共分散分析モデルを⽤いて解析した。モデルは層別変数(⽇本⼈/外国⼈、ベースライン治療)で層別化した。
MG-ADL総スコアを指標とした次のサイクルを開始する基準を満たすまでの期間は、層別変数により層別化し、Kaplan-Meier法(層別log-rank検定)を⽤いて解析した。
【探索的及びその他の評価項目】
その他の評価項目は、記述的な方法で解析した。絶対値とベースラインからの変化量から連続評価項目を、記述統計量により要約した。
さらに、ベースラインから各評価時点までのスコアの変化量、ベースライン以降(試験開始時及びサイクル開始時)の特定の時点での群間でのスコアの差などの連続変数は、MMRMを用いて解析した。また、ベースラインのスコアは層別因子と同様にMMRMに含めて解析した。患者内の反復測定のための非構造化(UN)共分散行列を解析用に特定し、各Visitについて以下の統計を提示する。
- 95%信頼区間
- 治療群間の差異を試験するための両側p値
【部分集団解析】
以下に示す要因が初回サイクルのMG-ADLレスポンダーの割合に与える影響を評価するため、部分集団解析を実施した:
抗AChR抗体発現状況(陽性/陰性)、人種(日本人/外国人)、併用gMG治療薬(非ステロイド性免疫抑制剤あり/なし)、ベースラインのMG-ADL総スコア(5~7点/8~9点/10点以上)及び治療サイクル数。
【その他】
有害事象を含むすべてのバイナリ変数に対しては頻度分布表を作成する。