試験の概要、安全性及び有効性の結果は2回目の中間解析(中間解析2:2020年10月8日をデータカットオフ日とした解析)に基づいて記載し、薬力学及び免疫原性の結果は1回目の中間解析(中間解析1:2020年4月6日をデータカットオフ日とした解析)に基づいて記載しています。
国際共同第Ⅲ相継続投与試験(ARGX-113-1705)※
(ARGX-113-1704の継続投与試験)1)
(ARGX-113-1704の継続投与試験)1)
試験概要
目的
gMG患者を対象にウィフガート®の長期投与時の安全性及び忍容性を評価する
デザイン
国際共同第Ⅲ相試験(ARGX-113-1704)の継続投与試験、長期、単群、非盲検、多施設共同(欧州、 米国、カナダ、ロシア、日本)
対象
ARGX-113-1704に参加し、継続投与試験に移行したgMG患者139例(日本人10例)
主な選択基準
- ARGX-113-1704に参加した患者で本試験に移行するための適格性基準に合致していること:
- ARGX-113-1704の試験終了時であるDay 182まで試験を継続した患者
- ARGX-113-1704で次のサイクルを開始する基準に合致したが、同試験の期間中に治療サイクルを完了できない患者は、直ちに本試験に移行してウィフガート®による治療を受けられることとした。
- ARGX-113-1704試験期間中に、妊娠、レスキュー療法、又は重篤な有害事象以外の理由で割り付けられた治療を早期中止した患者は、本試験に移行できることとした。
- ARGX-113-1704で割り付けられた治療を一時中断した患者には、本試験に移行できることとした。
- 試験参加前にベースライン治療※を一定の用量で継続している患者
※: ベースライン治療はコリンエステラーゼ阻害薬、経口副腎皮質ステロイド及び/又は非ステロイド性免疫抑制剤(アザチオプリン†、メトトレキサート†、シクロスポリン、タクロリムス、ミコフェノール酸モフェチル†及びシクロホスファミド†)に限る。
†:MGの治療に対し、本邦未承認である。
投与方法
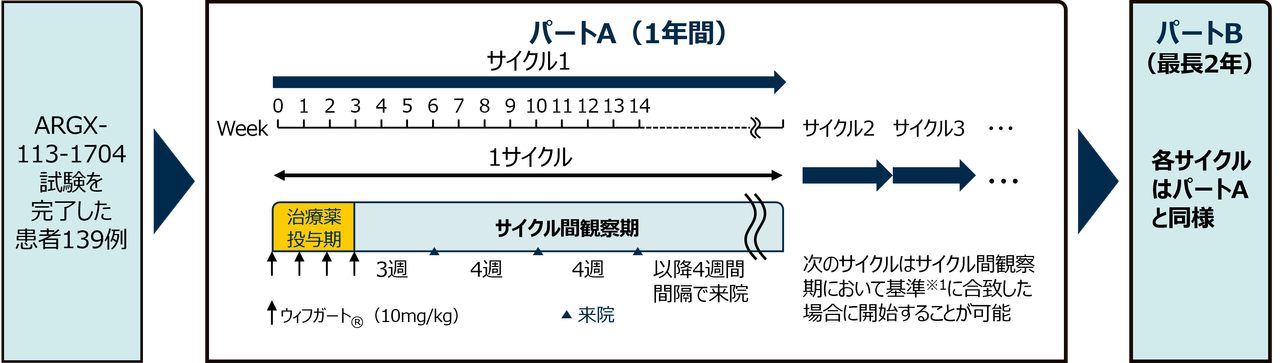
- 本試験はパートA(1年間)とパートB(最長2年)の連続する2パートで構成された。パートBは、患者がウィフガート®の投与を継続的に受けられるように追加されたパートである。
- 治験薬投与期の3週間後に4週間間隔で来院し観察を行うこと(サイクル間観察期)を1サイクルとし、次のサイクルはサイクル間観察期において基準※1に合致した場合に開始することが可能とされた。
- 治験薬投与期にコリンエステラーゼ阻害薬、経口副腎皮質ステロイド及び/又は非ステロイド性免疫抑制剤※2投与下で、ウィフガート®10mg/kgを1週間間隔※3で計4回1時間かけて静脈内投与した。
※1: 次のサイクル投与は、臨床症状として以下の基準のいずれも合致した場合に、開始することとされた。
- MG-ADL総スコアが合計5点以上であり、眼症状以外の項目でのスコアが50%を超えている患者
- MG-ADL総スコアが先行のサイクル投与のベースラインに対して2点以上の減少が認められない患者
※2: アザチオプリン†、メトトレキサート†、シクロスポリン、タクロリムス、ミコフェノール酸モフェチル†及びシクロホスファミド†
†:MGの治療に対し、本邦未承認である。
※3:1週間間隔の治験薬投与において、来院の許容期間は±1日と設定された。
評価項目
【主要評価項目】
抗AChR抗体陽性患者を対象に全試験期間にわたる有害事象、重篤な有害事象の発現割合及び重症度、バイタルサイン、心電図検査、臨床検査評価(パートA及びパートB)
【副次評価項目】
全体集団(抗AChR抗体陽性及び陰性患者)を対象に全試験期間にわたる有害事象、重篤な有害事象の発現割合及び重症度、バイタルサイン、心電図検査、臨床検査評価(パートA及びパートB)
【探索的評価項目】
- 各サイクルのベースライン(治験薬初回投与日)値と比較したMG-ADL総スコアの変化量(パートAのみ)[抗AChR抗体陽性患者、全体集団(抗AChR抗体陽性及び陰性患者)]
- 各サイクルのベースライン値と比較したQMG総スコアの変化量(パートAのみ)[抗AChR抗体陽性患者、全体集団(抗AChR抗体陽性及び陰性患者)]
【その他の評価項目】(中間解析1でのみ評価)
薬力学、免疫原性
解析方法
主要評価項目及び副次評価項目は、安全性解析対象集団を対象に記述統計量により要約した。すべての二値変数については、サイクル別及び全期間で頻度表を作成した。連続データは、絶対値及びベースラインからの変化量について要約統計量を示した。
探索的評価項目についても記述統計量により要約した。連続データについては、絶対値、ベースラインからの変化量、又はサイクルベースラインからの変化量について要約統計量を示した。中間解析のデータカットオフは1回目を2020年4月6日、2回目を2020年10月8日とした。
(注)本剤の「全身型重症筋無力症」に対する「用法及び用量に関連する注意」は以下の通りです。
7. 用法及び用量に関連する注意
〈全身型重症筋無力症〉
7.1 次サイクル投与の必要性は、臨床症状等に基づき、判断すること。[17.1.1、17.1.2参照]
7.2 本剤を投与する場合に、何らかの理由により投与が遅れた際には、あらかじめ定めた投与日から3日以内であればその時点で投与を行い、その後はあらかじめ定めた日に投与すること。あらかじめ定めた投与日から3日を超えていれば投与せず、次のあらかじめ定めた日に投与すること。
患者背景
本試験では、先行試験でウィフガート®を投与された患者をウィフガート®-ウィフガート®群と表示し、先行試験でプラセボを投与された患者をプラセボ-ウィフガート®群と表示しました。両群を合わせて、全体集団と表示しました。
先行する二重盲検試験に組み入れられた167例のうち、2020年10月時点で151例が本試験に移行し、139例がウィフガート®の投与を受けました。このうちウィフガート®-ウィフガート®群が73例、プラセボ-ウィフガート®群は66例でした。139例の全体集団のうち、106例は抗AChR抗体陽性、33例は抗AChR抗体陰性でした。
安全性評価(2020年10月8日データカットオフ時点)
副次評価項目
承認時に全体集団で評価されたため、全体集団の結果を示す。適応症は全身型重症筋無力症(ステロイド剤又はステロイド剤以外の免疫抑制剤が十分に奏効しない場合に限る)のため、適応症にあわせた安全性を提示する。
有害事象(全体集団)
全体集団における有害事象は139例中97例(69.8%)に認められました。
主な有害事象
主な有害事象は頭痛が29例(20.9%)、上咽頭炎が13例(9.4%)、下痢が9例(6.5%)でした。
重篤な有害事象
重篤な有害事象は17例(12.2%)26件に認められました。主な重篤な有害事象は重症筋無力症が3件、COVID-19、重症筋無力症クリーゼが各2件でした。
投与中止に至った有害事象
投与中止に至った有害事象は、7例(5.0%)9件に認められ、重症筋無力症が2件、急性心筋梗塞、死亡、COVID-19肺炎、脊椎圧迫骨折、筋肉痛、肺の悪性新生物、頭痛が各1件でした。
死亡に至った有害事象
死亡例は急性心筋梗塞、重症筋無力症クリーゼ、死亡、肺の悪性新生物が各1例で認められ、いずれも治験薬との因果関係は関連なしと判断されました。
特に注目すべき有害事象(AESI)と定義した感染症および寄生虫症
特に注目すべき有害事象(AESI)と定義したSOC「感染症および寄生虫症」の有害事象は、56例(40.3%)に報告されました。
3例以上で報告されたAESIは、上咽頭炎、尿路感染、上気道感染、帯状疱疹、気道感染、口腔ヘルペス、膀胱炎、及び気管支炎でした。有害事象共通用語規準(CTCAE)Grade 3以上のAESIは7例(5.0%)8件報告され、COVID-19が2件、COVID-19肺炎、赤痢、インフルエンザ、レンサ球菌性咽頭炎、大腸菌性肺炎、及び肺炎が各1件でした。同一患者で発現したインフルエンザ及びレンサ球菌性咽頭炎を除き、これらの事象はいずれも重篤でした。
心電図検査(全体集団)2)
480ms超のQTcF間隔、及びベースラインから60ms超のQTcF間隔延長がそれぞれ1例(0.7%)の患者で報告されました。
4例(2.9%)の患者で、心拍数増加(100bpm超)が報告されました。
臨床検査値(全体集団)3)
ウィフガート®投与による血中アルブミン値の低下は認められませんでした。多く報告されたCTCAE Grade 3以上の異常値はリンパ球数減少であり、12例(8.7%)の患者で認められました。臨床検査異常値の最悪値は、CTCAE Grade 4のリンパ球数減少1例(0.7%)を除き、すべてCTCAE Grade 3でした。
有効性評価
探索的評価項目
MG-ADL総スコアの変化量(2020年10月8日データカットオフ時点)
各サイクルでのベースラインから3週目(最終投与時)までのMG-ADL総スコアの変化量は下記の通りでした。なお、ARGX-113-1705では、規定来院日が少なく、Week 4、5及び6に設定されていないため、Week 3(4回目の投与時)のデータを表示しました。
各サイクルでのベースラインから3週目(最終投与時)までのMG-ADL総スコア変化量
| MG-ADL 総スコア | 抗AChR抗体 陽性集団 | 抗AChR抗体 陰性集団 | 全体集団 | ||||
|---|---|---|---|---|---|---|---|
| n | 平均値(標準誤差) | n | 平均値(標準誤差) | n | 平均値(標準誤差) | ||
| サイクル1 | ベースライン | 106 | 9.7(0.29) | 33 | 10.8(0.59) | 139 | 9.9(0.27) |
| 3週目 | 103 | -5.1(0.34) | 33 | -5.4(0.76) | 136 | -5.1(0.32) | |
| サイクル2 | ベースライン | 95 | 9.8(0.33) | 30 | 11.3(0.58) | 125 | 10.2(0.29) |
| 3週目 | 92 | -5.4(0.38) | 28 | -5.3(0.72) | 120 | -5.4(0.33) | |
| サイクル3 | ベースライン | 82 | 10.1(0.38) | 24 | 11.3(0.64) | 106 | 10.3(0.33) |
| 3週目 | 78 | -5.5(0.40) | 21 | -5.4(0.88) | 99 | -5.4(0.37) | |
| サイクル4 | ベースライン | 63 | 10.7(0.46) | 18 | 11.3(0.80) | 81 | 10.9(0.40) |
| 3週目 | 60 | -6.3(0.51) | 17 | -5.6(1.00) | 77 | -6.1(0.45) | |
| サイクル5 | ベースライン | 47 | 10.6(0.53) | 15 | 11.3(0.80) | 62 | 10.7(0.44) |
| 3週目 | 42 | -6.1(0.53) | 15 | -6.3(0.96) | 57 | -6.1(0.46) | |
| サイクル6 | ベースライン | 24 | 10.5(0.72) | 13 | 10.5(0.85) | 37 | 10.5(0.55) |
| 3週目 | 18 | -7.1(0.92) | 9 | -5.0(1.13) | 27 | -6.4(0.73) | |
| サイクル7 | ベースライン | 11 | 12.6(1.03) | 6 | 13.2(0.98) | 17 | 12.8(0.73) |
| 3週目 | 10 | -8.9(1.19) | 4 | -7.0(1.96) | 14 | -8.4(1.00) | |
上段:ベースラインのMG-ADL総スコア
下段:ベースラインから3週目(最終投与時)までのMG-ADL総スコアの変化量
QMG総スコアの変化量(2020年10月8日データカットオフ時点)
各サイクルでのベースラインから3週目(最終投与時)までのQMG総スコアの変化量は下記の通りでした。なお、ARGX-113-1705では、規定来院日が少なく、Week 4、5及び6に設定されていないため、Week 3(4回目の投与時)のデータを表示しました。
各サイクルでのベースラインから3週目(最終投与時)までのQMG総スコア変化量
| QMG 総スコア | 抗AChR抗体 陽性集団 | 抗AChR抗体 陰性集団 | 全体集団 | ||||
|---|---|---|---|---|---|---|---|
| n | 平均値(標準誤差) | n | 平均値(標準誤差) | n | 平均値(標準誤差) | ||
| サイクル1 | ベースライン | 106 | 15.6(0.54) | 33 | 16.1(1.00) | 139 | 15.7(0.47) |
| 3週目 | 100 | -4.7(0.41) | 33 | -5.2(0.74) | 133 | -4.8(0.36) | |
| サイクル2 | ベースライン | 95 | 16.3(0.59) | 30 | 16.2(1.01) | 125 | 16.3(0.50) |
| 3週目 | 86 | -5.4(0.43) | 25 | -3.8(0.74) | 111 | -5.0(0.38) | |
| サイクル3 | ベースライン | 79 | 15.7(0.65) | 24 | 16.5(0.90) | 103 | 15.9(0.54) |
| 3週目 | 67 | -4.5(0.54) | 20 | -5.7(1.03) | 87 | -4.8(0.48) | |
| サイクル4 | ベースライン | 57 | 15.7(0.79) | 17 | 15.4(1.66) | 74 | 15.6(0.71) |
| 3週目 | 48 | -4.5(0.64) | 11 | -4.8(1.00) | 59 | -4.6(0.55) | |
| サイクル5 | ベースライン | 39 | 16.6(0.90) | 12 | 16.2(1.18) | 51 | 16.5(0.74) |
| 3週目 | 31 | -4.2(0.68) | 10 | -4.6(1.10) | 41 | -4.3(0.57) | |
| サイクル6 | ベースライン | 20 | 16.9(1.25) | 10 | 17.1(1.59) | 30 | 16.9(0.97) |
| 3週目 | 13 | -6.3(1.15) | 5 | -5.4(1.96) | 18 | -6.1(0.97) | |
| サイクル7 | ベースライン | 11 | 19.1(1.44) | 5 | 20.2(1.46) | 16 | 19.4(1.07) |
| 3週目 | 9 | -5.9(1.21) | 3 | -7.7(2.19) | 12 | -6.3(1.03) | |
上段:ベースラインのQMG総スコア
下段:ベースラインから3週目(最終投与時)までのQMG総スコアの変化量
サイクル間隔(2020年10月8日データカットオフ時点)
ウィフガート®最終投与時から次のサイクル投与開始時までの期間(サイクル間隔)の中央値(各サイクルの中央値の範囲)は約4.1~6.1週間でした。
1)社内資料:第Ⅲ相試験(ARGX-113-1705試験)(承認時評価資料)(CTD 2.7.6.5)(EFG90009)
2) 社内資料:ARGX-113-1704試験及びARGX-113-1705試験(2022年1月20日承認、CTD2.7.4.4.1.4.2.2)(EFG90018)
3) 社内資料:ARGX-113-1704試験及びARGX-113-1705試験(2022年1月20日承認、CTD2.7.4.3.2.2)(EFG90019)
おすすめコンテンツ
JP-VDJCIDP-25-00752(2025年12月作成)


